|
|
|
叶绿体是植物进行光合作用的细胞器,分布在叶肉细胞内。叶绿体是由被膜、间质和类囊体三部分组成。依据分离所得叶绿体的结构完整程度,大致将叶绿体分成两类,一类为被膜已破碎的叶绿体,称之为破碎叶绿体,它具有光合电子传递、光合放氧和光合磷酸化的功能;另一类为被膜完整的叶绿体,它具有同化二氧化碳的完全的光合作用功能。下面分别介绍这两类叶绿体的制备以及被膜完整度的测定。
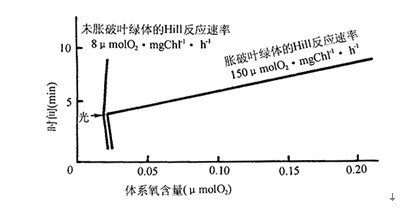
一、破碎叶绿体的制备 1.器材与试剂 (1) 器材 普通离心机(最好带有水平离心头)、研钵或电动捣碎器、分光光度计、冰箱、扭力天平、 pH计、量筒、移液管、离心管、脱脂纱布等。 (2) 试剂 ①提取液 O.4 mol/L蔗糖,O.O5 mol/L Tris-HCl(pH 7.6),0.01mol/L NaCl(简称STN溶液) ②80%的丙酮 2.操作方法 (1)叶绿体制备 取菠菜、豌豆或小麦苗等新鲜叶片,洗净后去除中脉,置于研钵或捣碎器中,加人冰冷的提取液,每10g叶片约加20m1冰冷的STN溶液。用手工研磨或用电动捣碎器捣碎,使叶片捣碎至碎米粒样大小,经过4层纱布过滤,滤液先以200×g离心1min,去除粗粒沉淀,上层液再以1000×g离心3min,倒掉上层液,沉淀为叶绿体。用少量STN溶液悬浮叶绿体,悬浮时可用棉球分散沉淀,并通过棉球吸取,以过滤叶绿体结块,叶绿体悬浮液置于冰浴中备用。 (2)叶绿素浓度测定 取叶绿体悬浮液0.1m1,加4.9 m1 80%的丙酮,摇匀后于1000×g离心2min,上清液置于l cm光径的比色杯,在波长为652nm处的分光光度计上比色。再按下列公式计算:652nm光密度读数(OD值)×50/34.5=叶绿素mg/ml叶绿体悬浮液。 3.注意事项 (1)提取叶绿体操作都在低温下进行,所用器皿都需预冷。 (2)叶绿体活力会随着离体时间延长而不断下降,因此,操作尽可能迅速,分离工作尽可能在短时间内完成。 (3)破碎的叶绿体制剂储存在液氮中,其Hill反应活性可保持较长时间,储存时叶绿体的浓度宜浓些(约3~4mg叶绿素/m1),并加25%体积的甘油。 二、完整叶绿体的制备 分离方法一般有两种,一是酶消化方法,把叶片表皮撕去后,用纤维素酶和果胶酶消化细胞壁,得到原生质体,再把原生质体通过尼龙网小孔(孔径20μm),使原生质体破裂而释放出完整叶绿体,但此方法分离得到的叶绿体数量有限。另一种是用机械方法,先用捣碎机破碎叶片,再分步离心,可以大量制备叶绿体。这里主要介绍离心法分离完整叶绿体。 1.器材与试剂 (1)器材 普通离心机(需带有水平离心头),或低温离心机、电动捣碎器、照光装置、氧电极测氧装置等。 (2)试剂 ①提取液:含0.33mol/L山梨醇,0.05 mol/L MES (pH 6.1),0.01 mol/L NaCl,2mmol/L MgC12,2 mmol/L EDTA-Na2,0.5 mmol/L KH2P04,2 mmol/L抗坏血酸钠(抗坏血酸钠宜在使用前现配现加) ②涨破叶绿体的Hill反应速率测定液:0.05 mol/L Tris-HCl(pH 7.6),5 mmol/L MgCl2,10 mmol/L NaCl,10 mmol/L K3Fe(CN)6。10 mmol/L NH4C1 ③0.66 mol/L山梨醇 ④Percoll(一种具有高密度和低渗透势的二氧化硅溶胶) 2.操作方法 (1)采摘新鲜菠菜或豌豆叶片 菠菜要选择嫩而厚,无显著皱纹的叶片,最好在早晨摘取,以免日照后在叶绿体内积累淀粉,不利于完整叶绿体的分离。豌豆也要选择嫩而厚的叶片,摘取后应尽快使用。叶片先在强光下照射15~20min,用以激活叶绿体,尤其用在完整叶绿体的以二氧化碳为底物放氧活性测定时,能使其缩短光合作用诱导期。为了防止强光照射下的温度上升,可把叶片铺放在冰块上,并在光源与叶片之间放隔水层。 (2)叶绿体制备 叶片去除叶柄及中脉后,以每10g叶片约加20~30ml冰冷的提取液。在电动捣碎器上高速捣碎,约2s/次,间隔捣碎3~4次,使叶片碎成绿豆粒样大小,然后经4层纱布过滤,去除残渣。注意过滤时不可用力挤压,以免叶绿体被膜破碎。滤液以1000×g离心,将离心管放人离心机后,使离心机的加速很快上升到预定值,经约30s后再很快使其下降停止,整个离心程序大约用2~3min左右完成。小心地倒出上清液,先用少许提取介质漂洗去沉淀表面的浮物,再加入悬浮介质:即把提取介质中的MES换成HEPES(pH7.6),悬浮叶绿体,在分散叶绿体沉淀时宜使用毛笔轻轻刷之,或者用手握住离心管,在冰块之间搅动,使叶绿体由于振动而分散开来,不要用棉球吸滤,以防被膜压破。叶绿体悬浮时要浓一些(含叶绿素2 mg/ml以上),这样有利于其活性的保持。 (3)叶绿体被膜完整率的进一步提高 上述方法所得叶绿体被膜完整率一般约在60%左右,好的时候也可达到70%以上。如果需要进一步提纯,一种简单的方法是再次用悬浮介质洗涤叶绿体,并用同样离心方法沉淀叶绿体,把破碎的叶绿体漂洗去,起着浮选作用,但用此方法提高被膜完整率的程度有限,而且叶绿体损失也多。另一种方法是用Percoll作为密度梯度介质,方法是将3m1含有80% Percoll(以原液为100%浓度,用水稀释),铺在10ml体积的离心管下层,再把3m1 40%Percoll铺在离心管的中层,然后将lml叶绿体悬浮液轻轻地铺在离心管的上层,用水平离心头的离心机在1500×g下离心2~3min,注意此时离心机的加速一定要缓慢上升,而下降时也要缓慢停下,否则会破坏Percoll的浓度梯度层的形成,取出离心管可以看到有3层绿色带,最上层的为破碎叶绿体,沉在底层的为粗颗粒,而40%~80% Percoll之间的界面上有一绿色层,是完整叶绿体,小心地将它吸取出来,转移到叶绿体悬浮介质里。此部分叶绿体的被膜完整率可达95%以上,有时甚至100%。Percoll介质可以重复使用,把密度梯度离心用过以后的40%和80% Percoll,分别吸取出来,存储于冰箱中以备下次使用。如果制备完整叶绿体的目的只是为了供叶绿体DNA的分离所用,则主要获得被膜完整率高的叶绿体制剂即可,不必考虑叶绿体同化二氧化碳的活性,因此提取介质可改用简单的STN溶液,但是操作顺序需按照制备完整叶绿体的方法,再用Percoll作密度梯度离心提纯。 三、叶绿体被膜完整率的测定 由于铁氰化钾不能透过叶绿体被膜,故完整叶绿体在等渗条件下不能进行铁氰化钾光还原的反应,而被膜破碎的叶绿体,铁氰化钾可进入叶绿体进行反应,利用此原理来比较被膜破碎与未破碎叶绿体的Hill反应速率的差别,就可测出叶绿体中被膜的完整率。被膜未破的叶绿体的Hill反应速率测定,是将上述被膜涨破叶绿体的Hill反应速率测定液,先以1:1体积与0.66 mol/L山梨醇混合,使之保持0.33 mol/L山梨醇浓度,再加入叶绿体(每毫升反应液约含叶绿素50μg),用氧电极方法测定Hill反应速率(参阅氧电极测氧方法)。被膜破碎的叶绿体Hill反应速率测定,是先与不含山梨醇的Hill反应液混合,使被膜在低渗介质下胀破,再以1:1体积与0.66mol/L山梨醇混合,使测定时也保持0.33mol/L山梨醇浓度,在相同条件下测定Hill反应速率。被膜完整率的计算如下: 被膜完整率(%)=[(被膜涨破叶绿体的Hill反应速率-完整叶绿体的Hill反应速率)/被膜涨破叶绿体的Hill反应速率 ]×100 测定计算实例见下图:
被膜完整率(%)=(150-8)/150 =94.7% 参考文献 中国科学院上海植物生理研究所,上海市植物生理学会编,现代植物生理学实验指南,1999,北京,科学出版社,1一3 《生物生产力和光合作用测定技术》(科学出版社1986) |